
5月31日,为规范#化妆品新原料研究和评价,指导新原料安全使用及食用历史相关资料的收集、判定以及在安全评估中的应用,根据相关法规和配套文件要求,中检院起草了《化妆品新原料#安全使用历史研究和判定指南(试行)(征求意见稿)》《化妆品新原料#安全食用历史研究和判定指南(试行)(征求意见稿)》2项技术文件。
![]() 安全食用历史
安全食用历史
1.证明资料基本要求
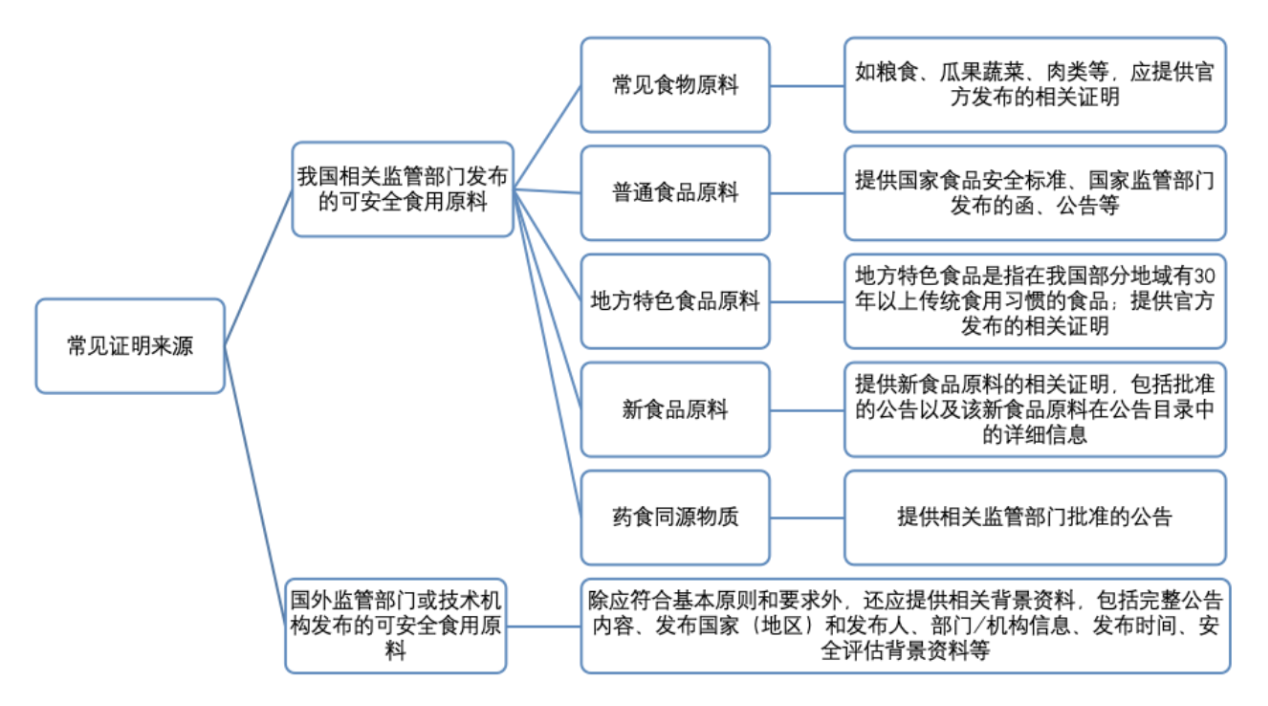
指南中明确安全食用历史证明资料中载明的原料应为取得我国相关监督管理部门食品安全认证或其他相应资质的食品用原料,或经国内外相关监督管理部门、权威技术机构发布的可安全食用的原料,且与拟注册备案新原料具有一定的对应关系。具体可从食用历史证明资料来源、原料一致性/相关性、食用情况和限制要求等方面,对资料信息进行收集并开展适用性分析。
应来源于食品、农业、卫生等相关领域的监督管理部门,或具有食品安全风险评估相关职能或技术能力的技术机构,应是公开发布的数据信息,且具有一定权威性。其中,我国监督管理部门应是省级及以上,如相关部门发布的公告、通知、技术标准等。国外监督管理部门应至少是国家级,技术机构应是国际公认的权威机构或组织。
应根据安全食用历史证明资料中载明信息,与拟注册备案新原料的相关信息进行比对分析,充分说明二者的一致性或相关性。
|
来源分类 |
要求 |
|
拟注册备案新原料与安全食用历史证明资料中载明的食品原料完全一致 |
应充分证明两者一致性,包括来源、工艺、实际组成、使用规格等 |
|
动物或植物 |
由专业机构进行种属鉴定,且与动植物食用部位一致;来源为动物,还应提供动物卫生监督机构检验、检疫合格相关证明 |
|
安全食用历史证明资料中载明的是原材料形式,拟注册备案新原料在此基础上作进一步加工 |
应充分证明生产化妆品新原料所用原材料与资料载明食品原料的一致性,且加工方式应与食品食用加工方式基本一致(如仅水提、蒸煮等),必要时对成分变化和富集情况进行分析 |
|
生物发酵类原料 |
菌种和底物各自安全食用历史并不代表发酵产物安全可食用,应提供最终获得发酵产物可作为食品原料的安全食用证明资料 |
应结合所采用的安全食用历史证明资料,提供在食品中食用情况和限制要求,如食用方式、用途、食用限量、适宜及不适宜人群、注意事项等,并结合拟注册备案新原料进行分析,对食用限制要求中提示的安全风险予以特别关注。证明资料中未包含相关信息的,也应自行开展研究和充分分析。
对于有食用限制要求的保健食品原料、食品添加剂等,应充分研究在食品中的具体使用要求,包括食用限量、食用人群、注意事项及其他限制条件,分析作为化妆品新原料使用的安全性。尤其对于其中安全风险较高原料,应对原料毒性信息进行全面研究。
2.常见来源
![]() 安全使用历史
安全使用历史
1.基本要求
安全使用历史相关证明资料,应能够充分说明拟注册备案新原料在已上市化妆品中的使用情况以及上市时间、使用数量、安全性等有关情况。具体可从原料一致性、已上市化妆品类型和上市时间、已上市化妆品使用数量、不良反应监测情况等方面,开展资料信息收集工作,并结合已收集资料进行情形判定。
Ø 原料一致性
确保证明资料中已上市化妆品所用原料与拟注册备案新原料为同一原料,具体应在原料组成、质量规格、生产工艺等方面保持一致。
提供的证明资料中,应体现已上市化妆品中实际使用原料的具体信息,以便判断与拟注册备案新原料的一致性,如:原料名称、分子式、结构式、相对分子质量;原料来源、生产工艺;原料实际组成、纯度或含量;感官指标、理化常数;杂质种类及其控制指标等。
Ø 已上市化妆品类型和上市时间
所提供证明资料中的已上市化妆品应符合我国法规中对于化妆品的定义。当使用新原料的产品在境外不按照化妆品管理、但符合我国化妆品定义时,应提交相关产品在境外的监管情况、法规文件以及产品功效、作用机理等情况说明。
新原料在已上市化妆品中的使用目的、适用或使用范围等,应与注册备案资料中的相关内容一致;新原料在已上市化妆品中的使用量,应不低于注册备案资料中填报的安全使用量。
符合上述要求的含新原料的化妆品已上市时间应不少于三年,且至少有一款产品连续销售满三年及以上。
Ø 已上市化妆品使用数量
重点关注连续销售满三年及以上的含新原料的已上市化妆品,确保其有足够的使用数量:如采用终端零售化妆品销售数量(即消费者实际购买数量)为依据,则三年累计销售数量不得低于10000件,其中每年销售数量不得低于3000件;如采用化妆品生产企业出厂量为依据,则三年累计出厂量不得低于100000件,其中每年不得低于30000件。
对于具有防腐、防晒、着色、染发、祛斑美白、防脱发、祛痘、抗皱(物理性抗皱除外)、去屑、除臭功能的新原料,除上述要求外,还应确切掌握不少于100名消费者长期(1年及以上)连续使用同一产品的情况。应根据原料结构或功能容易导致的不良反应,有针对性地对消费者进行追溯和回访调查,并对实施情况、化妆品使用和不良反应情况等进行规范记录。
Ø 安全使用和不良反应监测情况
新原料注备人应开展全面调研,掌握该原料是否会对人体健康产生危害以及使用该原料的已上市化妆品的不良反应情况。不良反应情况应包括化妆品生产企业收集含该原料化妆品不良反应事件的渠道和方式以及含该原料化妆品自上市以来,是否有消费者使用化妆品出现不良反应的记录。如有,应计算不良反应发生率,确定不良反应情况的类型并对不良反应情况以及产生的原因进行分析,形成分析报告。新原料注备人应根据调研情况,形成关于该原料已上市化妆品的不良反应情况综述。
2.形式要求
化妆品新原料注备人应按照基本要求,对相关资料和有关情况进行收集、整理、总结和分析,形成新原料的安全使用历史情况综述,附相关表格(参考内容和格式如下),并提供可追溯的相关证明材料。
表 1 已上市化妆品的销售数量情况
|
产品 名称 |
产品 类型 |
产品 生产企业 |
产品中新原料的使用量 |
产品中新原料使用目的 |
产品使用范围 |
年度(X年X月-X年X月) |
销售 方式 |
销售地点 |
销售 数量 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
注:同一产品每一年的销售情况应分别列出
据统计,共有 款化妆品使用了新原料 (原料名称),化妆品累计销售 件。其中,连续销售满三年及以上的为 ,累计销售 件。
(化妆品新原料注册人或备案人签章)
年 月 日
表 2 已上市化妆品消费者长期连续使用情况(如涉及)
|
产品类型 |
产品名称 |
产品 生产企业 |
产品中新原料的使用量 |
产品中新原料使用目的 |
产品使用范围 |
消费者姓名(首字母) |
消费者性别 |
消费者年龄 |
回访调查方式 |
连续使用时间(X年X月-X年X月) |
消费者使用和不良反应情况 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(化妆品新原料注册人或备案人签章)
年 月 日
表 3 已上市化妆品不良反应监测情况
|
产品名称 |
产品类型 |
产品生产企业 |
产品中新原料的使用量 |
产品中新原料使用目的 |
产品使用范围 |
不良反应收集时间 |
产品不良反应类型(如一般不良反应、严重不良反应、群体不良反应等) |
产品不良反应具体描述(包括发病部位等) |
产品不良反应发生例数 |
产品不良反应发生率 |
产品不良反应收集渠道 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(化妆品新原料注册人或备案人签章)
年 月 日
原文相关链接:https://www.nifdc.org.cn/nifdc/bshff/hzhpjssp/hzpsptzgg/202405310859501097761.html
该征求意见截止至2024年6月18日,若有反馈意见,可发送电子邮件至hzppjzx@nifdc.org.cn。