
2025年6月24日,为落实国家药监局《支持化妆品原料创新若干规定》,加强对新原料情形判定及分类研究的技术指导,根据《化妆品监督管理条例》《化妆品注册备案管理办法》等相关法规要求,中检院制定了《#化妆品新原料安全使用历史研究和判定指南(试行)》和《#化妆品新原料安全食用历史研究和判定指南(试行)》(详见附件1、2)。
为了帮助大家更清晰、全面地对比相关内容,OCI特为各位进行系统性的梳理具体内容如下:

注:信息来源于中国食品药品检定研究院,以官方发布信息为准。
相关问答如下:
|
《化妆品新原料安全使用历史研究和判定指南(试行)》 |
《化妆品新原料安全食用历史研究和判定指南(试行)》 |
|
一、《化妆品新原料安全使用历史研究和判定指南(试行)》的制定背景是什么? 根据《化妆品监督管理条例》,申请化妆品新原料注册或者进行化妆品新原料备案时,应当提交新原料安全评估资料。其中,对于在化妆品中已有充足的安全使用历史的新原料,能够减免部分毒理学试验项目。 为落实国家药监局《支持化妆品原料创新若干规定》,加强已有数据利用,中检院组织制定《化妆品新原料安全使用历史研究和判定指南(试行)》(以下简称《指南》),为安全使用历史相关资料的收集、判定以及在安全评估中的应用提供技术指导。 |
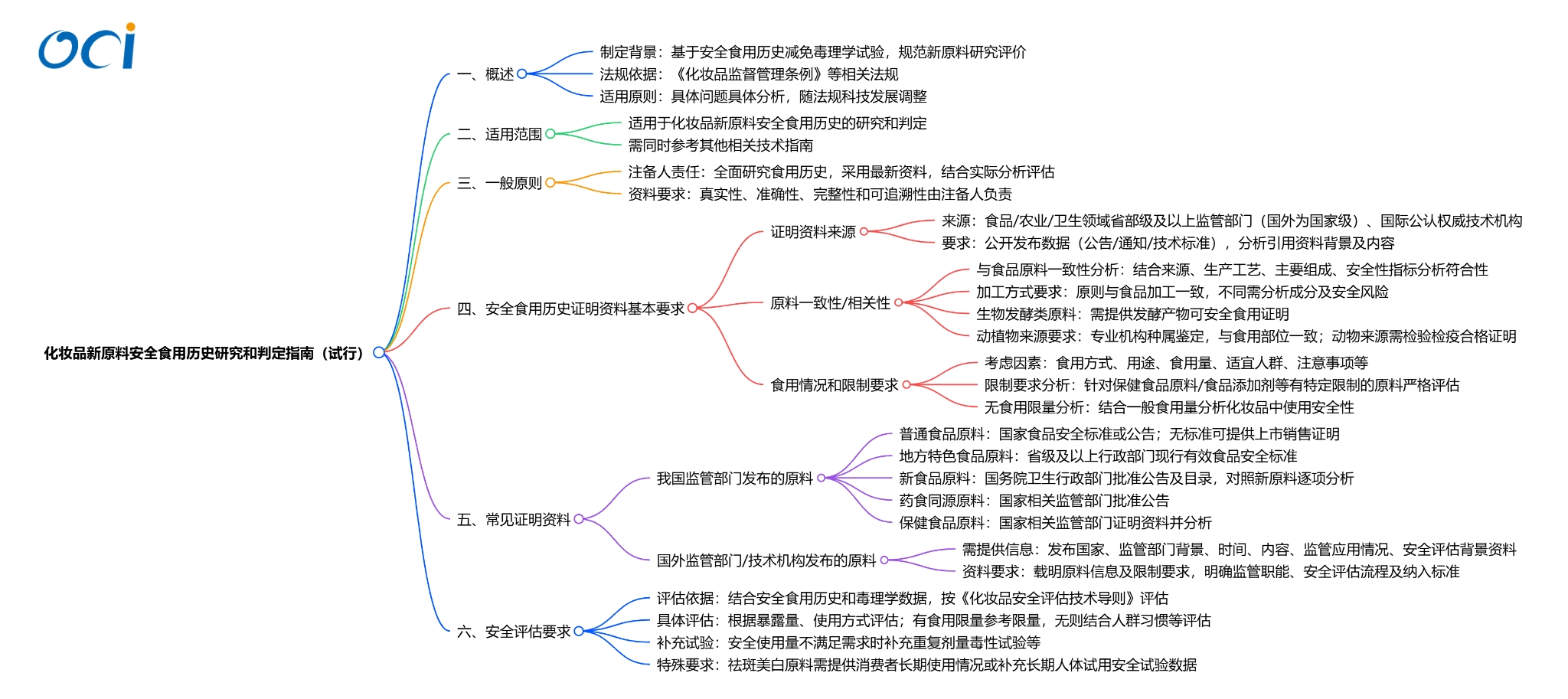
一、《化妆品新原料安全食用历史研究和判定指南(试行)》的制定背景是什么? 根据《化妆品监督管理条例》,申请化妆品新原料注册或者进行化妆品新原料备案时,应当提交新原料安全评估资料。其中,对于具有充足的安全食用历史的新原料,能够减免部分毒理学试验项目。 为落实国家药监局《支持化妆品原料创新若干规定》,加强已有数据利用,中检院组织制定《化妆品新原料安全食用历史研究和判定指南(试行)》(以下简称《指南》),为安全食用历史相关资料的收集、判定以及在安全评估中的应用提供技术指导。 |
|
二、拟注册备案新原料是否需要与安全使用历史中的原料完全一致? 新原料注册人、备案人(以下简称注备人)应从原料来源、生产工艺、原料组成、质量规格等方面进行原料一致性分析。对于具有明确单一化学结构的新原料,应确保分子式、结构式等关键信息一致;因原料质量提升、环境友好等原因对生产工艺进行调整的,应结合工艺调整情况,对原料含量(纯度)、杂质组成及其他可能产生的变化情况进行全面分析。对于其他类型的新原料,如植物提取物、微生物发酵产物、高分子聚合物等,则应确保所引用安全使用历史证明资料中原料与拟注册备案新原料一致。 此外,对于实际以复配形式进行销售的,应分析复配原料中其他成分对功效、安全等可能产生的影响,充分考虑作为拟注册备案新原料安全使用历史依据的科学合理性。 |
二、安全食用历史证明资料来源有什么要求? 安全食用历史证明资料应来源于食品、农业、卫生等相关领域的监督管理部门,或具有食品安全风险评估相关职能或技术能力的技术机构,应具有一定权威性,且一般应是公开发布的数据信息(如公告、通知、技术标准等)。其中,我国监督管理部门应为省部级及以上;国外监督管理部门应为国家级;技术机构应为国际公认的权威机构或组织。 此外,在采用安全食用历史证明资料时,应同时对引用资料背景、具体资料内容、食品安全监管相关要求等进行全面分析,充分说明可安全食用的有关情况。 |
|
三、安全使用历史证明资料中的已上市化妆品有什么要求? 安全使用历史证明资料中的已上市化妆品应符合我国法规对于化妆品的定义范畴。当产品在境外不按照化妆品管理但符合我国化妆品定义时,应提供相关产品在境外的监管背景、法规要求以及产品功效、作用机理等相关资料,并对符合我国化妆品定义的有关情况进行分析说明。此外,已上市化妆品的原料使用浓度、使用部位、使用方法等应能够支持注册备案资料中填报的适用或使用范围、安全使用量等相关信息。 |
三、拟注册备案新原料与安全食用历史中载明的食品原料应有何一致性或相关性? 拟注册备案新原料应与安全食用历史证明资料中载明的食品原料具有一致性或相关性,新原料注册人、备案人(以下简称注备人)应结合安全食用历史证明资料以及拟注册备案新原料有关情况进行分析。 需要指出的是,如加工方式与食品食用加工方式不一致(如使用其他溶剂提取等),应结合具体的工艺类型,对组成成分及富集情况、残留溶剂等进行分析;对生物发酵类新原料,应提供最终获得的发酵产物可安全食用的相关证明资料。 |
|
四、已上市化妆品的上市时间和使用数量有什么要求? 已上市化妆品上市时间应不少于3年,可以是同一款产品连续销售满3年及以上,或者多款产品累计连续销售满3年及以上。如产品上市时间较早,应充分考虑相关信息的可靠性和可追溯性。 此外,应确保相关产品具有足够的使用数量。原则上,如采用终端零售化妆品销售数量(即消费者实际购买数量),则3年累计销售数量不得低于10000件,其中每年不得低于3000件;如采用间接销售数据,如化妆品生产企业出厂量、分销商销售量等,则3年累计销售数量不得低于100000件,其中每年不得低于30000件。 |
四、常见的安全食用历史证明资料有哪些? 常见的安全食用历史主要来自普通食品原料、地方特色食品原料、新食品原料、药食同源原料、保健食品原料等。为指导新原料注备人收集和利用相关信息,在《指南》中列举了部分常见证明资料及其基本要求。 其中,考虑到部分普通食品原料可能缺少官方发布的相关依据,新原料注备人可说明相关情况,提供已在我国境内作为普通食品原料上市销售的相关证明材料,并对安全食用情况等进行分析说明。所提供证明资料应具有关联性、可追溯性,并能够准确体现与拟注册备案新原料的一致性或相关性。 |
|
五、新原料注备人应如何开展安全使用情况分析? 新原料注备人应开展全面调研,详细说明收集不良反应事件的渠道和方式,以及使用该原料的化妆品自上市以来是否出现不良反应的记录或对人体健康产生危害的其他相关报道,并作必要分析。在此基础上,结合该原料上市使用的整体情况,对新原料的使用历史情况进行科学合理的评估,形成该原料是否曾引起严重不良反应或者群体不良反应事件以及是否可能对人体健康产生危害的明确结论。 对于具有祛斑美白功能的新原料,还应关注长期作用于人体皮肤的安全风险,例如提供不少于100名消费者长期(1年及以上)连续使用同一产品的有关情况。如无法提供相关信息,也可选择开展长期人体试用安全试验,提供相关研究数据。 |
五、能否使用国外监管部门或技术机构发布的相关证明资料? 以国外监管部门或权威技术机构发布的可安全食用原料相关信息作为安全食用历史证明的,除应符合相关原则和要求外,还应提供相关背景信息,包括发布国家(地区)、监管部门/技术机构背景信息、发布时间、发布信息完整内容、食品安全监管具体应用情况、安全评估背景资料等。 |
|
六、使用历史证明资料有何形式要求? 新原料注备人应按照安全使用历史证明资料的基本要求,对相关资料和有关情况进行收集、整理、分析和总结,形成新原料安全使用历史情况综述,附相关附表(样例见《指南》附表1-表3),并提供可追溯的相关证明材料。 考虑到各国在产品销售记录留存、追溯等方面有不同的规定和习惯,《指南》未对证明材料形式作具体限制要求。新原料注备人应充分掌握实际情况,并根据其销售、使用的具体方式,自行整理形成证明资料。所提供证明资料应具有关联性、可追溯性,并体现必要的生产经营等关键信息。如已上市化妆品非新原料注备人生产,应说明信息来源并取得相应授权。 |
六、应如何对具有安全食用历史的化妆品新原料开展安全风险评估? 在食品中有明确食用限量或其他限制要求的,应根据新原料的适用或使用范围、安全使用量等信息,评估新原料在化妆品中使用的安全性;无明确食用限量的,可结合人群饮食习惯、常规食用量等信息,开展合理评估。对原材料作进一步加工的,如植物提取物形式,应考虑必要的折算。 根据食用限量或常规食用量,无法满足新原料在化妆品中的使用需求的,可补充重复剂量毒性试验数据及其他必要数据,对新原料的使用范围、安全使用量等进行评估,同时一并提供完整、规范的毒理学试验报告。 此外,安全食用历史主要用于减免系统毒性相关试验项目,对于具有祛斑美白功能的新原料,无法排除其作为化妆品原料长期作用于人体皮肤的安全风险,应补充必要数据或试验研究。 |
我们相信,随着指南的深入落实,化妆品新原料的管理将更加科学、规范,化妆品行业也将在安全与创新的良性互动中,迎来更加繁荣、美好的明天。期待化妆品企业能够以指南为契机,不断创新突破,为消费者带来更多优质、安全、高效的产品,共同推动我国化妆品行业迈向新的高度。
北京正智远东(OCI)公司自2006年成立以来,帮助不同国家的知名原料与产品公司提供申报服务和技术指导,是世界500强125家企业的咨询服务机构。自2021年化妆品新法规实施以来,OCI是第一批获得备案公示成功案例的技术服务机构,且目前已备案公示的新原料中,20%以上由我司协助完成。通过丰富的经验,帮助客户选择合适的备案路径,最大程度地节省费用并提高备案效率。秉承5A服务理念为客户提供一站式服务。